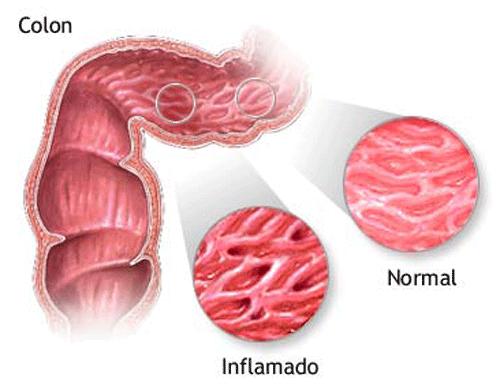
 “Ya casi olvidé el sabor del plátano frito, los frijoles, los productos lácteos… si no sigo una dieta estricta me desestabilizo, sufro diarreas, cólicos muy fuertes y me siento débil, como en el aire”, advirtió el paciente de 64 años, Alberto Fariñas Placencia, quien padece la enfermedad de Crohn. Perteneciente al grupo de afecciones inflamatorias del intestino, junto a la colitis ulcerativa y la indeterminada, el de Crohn es un padecimiento crónico, autoinmune, que puede afectar todas las capas del intestino, e incluso, sus estructuras contiguas a través de fístulas. Los índices de incidencia en el mundo registran de 3 a 20 enfermos cada 6 mil habitantes. Sin embargo, la proporción que para algunos pudiera representar un episodio lejano es resultado de una tasa de prevalencia “disparada” 25 veces más que la existente hace cuatro décadas. Conocer al “enemigo” De causas aún indeterminadas, los científicos creen que en la enfermedad de Crohn bacterias y virus inofensivos son atacados por el sistema inmunológico. Durante esta aparente defensa, los glóbulos blancos se concentran en el revestimiento intestinal, provocando una inflamación, que a su vez causa lesiones, llagas y úlceras en la mencionada zona. “Esta afección es capaz de dañar cualquier segmento del aparato digestivo. No es hereditaria, pero hay quienes nacen con una predisposición genética que los hacen más propensos a padecerla, sobre todo si tienen antecedentes patológicos en familiares de primer grado”, explicó el doctor Francisco Lorenzo Castillo, especialista de segundo grado en Medicina General Integral y Gastroenterología del Hospital General Provincial Camilo Cienfuegos de Sancti Spíritus. “De tal modo, esa persona crea anticuerpos contra cualquier agente ambiental: componentes de la dieta, estructuras moleculares o parásitos. Es por eso que hablamos de una dolencia autoinmune”. Entre los factores desencadenantes, el también Máster en Medios Diagnósticos, mencionó los malos hábitos higiénicos y dietéticos, así como el tabaquismo, un vicio que contribuye a la aparición del Crohn y complica el estado del paciente. Dolor abdominal, fiebre, pérdida de peso, fatiga, inapetencia, diarrea acuosa, sensación de que necesita defecar, aun con los intestinos limpios, y hemorragia en el recto resultan algunos síntomas que aparecen en los aquejados. Pero este mal conduce también a dificultades extradigestivas. “Los pacientes pueden presentar lesiones en la piel, alteraciones en el hígado, daños renales, oculares, articulares, en los sistemas biliar y excretor; además, en los análisis aparecen los niveles bajos de albúmina, anomalías en las pruebas de la función hepática, así como el conteo de glóbulos blancos alto y la hemoglobina en descenso”, apuntó el especialista. Anemia, falta de nutrientes esenciales (hierro y vitamina B12), obstrucción intestinal, osteoporosis, crecimiento y desarrollo sexual lento en los niños y fístulas en la vejiga devienen otros problemas asociados al agravamiento de la enfermedad. Períodos de bienestar y reagudización de los síntomas caracterizan a este padecimiento que precisa ser contrarrestado a tiempo, pues quienes lo sufren tienen mayores posibilidades de desarrollar el cáncer de colon y de intestino delgado. “Esta es una enfermedad inflamatoria intestinal que provoca complicaciones extradigestivas. Es esencial la prevención”, aseguró el doctor Lorenzo Castillo.
“Ya casi olvidé el sabor del plátano frito, los frijoles, los productos lácteos… si no sigo una dieta estricta me desestabilizo, sufro diarreas, cólicos muy fuertes y me siento débil, como en el aire”, advirtió el paciente de 64 años, Alberto Fariñas Placencia, quien padece la enfermedad de Crohn. Perteneciente al grupo de afecciones inflamatorias del intestino, junto a la colitis ulcerativa y la indeterminada, el de Crohn es un padecimiento crónico, autoinmune, que puede afectar todas las capas del intestino, e incluso, sus estructuras contiguas a través de fístulas. Los índices de incidencia en el mundo registran de 3 a 20 enfermos cada 6 mil habitantes. Sin embargo, la proporción que para algunos pudiera representar un episodio lejano es resultado de una tasa de prevalencia “disparada” 25 veces más que la existente hace cuatro décadas. Conocer al “enemigo” De causas aún indeterminadas, los científicos creen que en la enfermedad de Crohn bacterias y virus inofensivos son atacados por el sistema inmunológico. Durante esta aparente defensa, los glóbulos blancos se concentran en el revestimiento intestinal, provocando una inflamación, que a su vez causa lesiones, llagas y úlceras en la mencionada zona. “Esta afección es capaz de dañar cualquier segmento del aparato digestivo. No es hereditaria, pero hay quienes nacen con una predisposición genética que los hacen más propensos a padecerla, sobre todo si tienen antecedentes patológicos en familiares de primer grado”, explicó el doctor Francisco Lorenzo Castillo, especialista de segundo grado en Medicina General Integral y Gastroenterología del Hospital General Provincial Camilo Cienfuegos de Sancti Spíritus. “De tal modo, esa persona crea anticuerpos contra cualquier agente ambiental: componentes de la dieta, estructuras moleculares o parásitos. Es por eso que hablamos de una dolencia autoinmune”. Entre los factores desencadenantes, el también Máster en Medios Diagnósticos, mencionó los malos hábitos higiénicos y dietéticos, así como el tabaquismo, un vicio que contribuye a la aparición del Crohn y complica el estado del paciente. Dolor abdominal, fiebre, pérdida de peso, fatiga, inapetencia, diarrea acuosa, sensación de que necesita defecar, aun con los intestinos limpios, y hemorragia en el recto resultan algunos síntomas que aparecen en los aquejados. Pero este mal conduce también a dificultades extradigestivas. “Los pacientes pueden presentar lesiones en la piel, alteraciones en el hígado, daños renales, oculares, articulares, en los sistemas biliar y excretor; además, en los análisis aparecen los niveles bajos de albúmina, anomalías en las pruebas de la función hepática, así como el conteo de glóbulos blancos alto y la hemoglobina en descenso”, apuntó el especialista. Anemia, falta de nutrientes esenciales (hierro y vitamina B12), obstrucción intestinal, osteoporosis, crecimiento y desarrollo sexual lento en los niños y fístulas en la vejiga devienen otros problemas asociados al agravamiento de la enfermedad. Períodos de bienestar y reagudización de los síntomas caracterizan a este padecimiento que precisa ser contrarrestado a tiempo, pues quienes lo sufren tienen mayores posibilidades de desarrollar el cáncer de colon y de intestino delgado. “Esta es una enfermedad inflamatoria intestinal que provoca complicaciones extradigestivas. Es esencial la prevención”, aseguró el doctor Lorenzo Castillo.

“Esta es una enfermedad inflamatoria intestinal que provoca complicaciones extradigestivas. Es esencial la prevención”, aseguró el doctor Lorenzo Castillo. Foto: De la autora ¿Qué armas tenemos? La etapa de mayor riesgo para que se manifieste la enfermedad es desde la adolescencia hasta los 35 años; sin embargo, las personas muchas veces son prescritas con ella en la quinta o sexta década de la vida, dada su característica de ser lentamente progresiva. “Puede que reaparezca mucho tiempo después de estar en el organismo; también por eso es extremadamente difícil de diagnosticar, sobre todo porque a veces no contamos con la tecnología requerida. Nosotros hacemos un análisis clínico, estudios de imagen para buscar alteraciones y exámenes endoscópicos al paciente. “Aunque empleamos la biopsia, esta no nos permite llegar al granuloma caseificante (lesión típica en estos casos), debido a su ubicación. No obstante, el método nos proporciona elementos de apoyo y, junto al seguimiento minucioso, podemos acertar en el diagnóstico”, precisó Lorenzo Castillo. El tratamiento responde, según la fuente, a distintas etapas, priorizando siempre el trabajo preventivo. Hervir el agua, luchar contra el tabaquismo y llevar dietas ricas en vegetales son prácticas que ofrecen grandes probabilidades de mantenerse saludable. “Tras la presencia de la afección en el organismo, proponemos medidas generales y específicas en correspondencia con el estado de salud de la persona. Aunque ningún fármaco representa una cura definitiva, prescribimos antinflamatorios intestinales, esteroides, metronidazol, antibióticos e inmunodepresores, para asegurar cuanto sea posible el bienestar del aquejado”. En el mundo se emplean otros paliativos como las llamadas terapias biológicas y la oxigenación hiperbárica, e incluso, está la opción de una cirugía; eso es en el momento preciso, nunca recurrimos a ella si hay respuesta con otro tipo de procedimiento”, aclaró el gastroenterólogo. Regular las porciones de comidas, ingerir suficientes calorías, proteínas y nutrientes de distintos grupos de alimentos, beber bastante agua a lo largo del día, evitar las grasas, los frijoles, palomitas de maíz, condimentos artificiales, reducir los productos lácteos y todo comestible que le cause daños al individuo afectado, resultan otras precauciones para garantizar su bienestar. Según Lorenzo Castillo, “el apoyo psicológico de la familia es un elemento insustituible para el paciente, pues las situaciones de estrés pueden acelerar la enfermedad y algunos se sienten limitados para desenvolverse cotidianamente”. El entrevistado dijo, además, que la reestructuración de la consulta de gastroenterología ha sido una alternativa para preservar la calidad de vida de quienes sufren un síndrome que a diario establece metas para la medicina internacional. “Desde el año 2000 creamos el espacio para tratar las Enfermedades Inflamatorias del Intestino. Bajo supervisión especializada mantenemos un grupo de pacientes que han sido diagnosticados y otros (la mayoría) son sospechosos de padecer el mal. Estos últimos permanecerán con nosotros el tiempo necesario, porque el día de mañana pueden aparecer características que los precisen como portadores de la enfermedad de Crohn. “Velar por su evolución significa para ellos la oportunidad de llevar una vida lo más normal posible. Es también una garantía, porque antes llegaban a nuestras manos en un estado crítico por el avance de la afección intestinal. Ahora somos nosotros quienes le ganamos terreno”, concluyó.
Autora: Elisdanys López Ceballos.
Fuente: Periódico «Trabajadores»
http://www.trabajadores.cu/20140901/ganarle-terreno-al-crohn/
 “Ya casi olvidé el sabor del plátano frito, los frijoles, los productos lácteos… si no sigo una dieta estricta me desestabilizo, sufro diarreas, cólicos muy fuertes y me siento débil, como en el aire”, advirtió el paciente de 64 años, Alberto Fariñas Placencia, quien padece la enfermedad de Crohn. Perteneciente al grupo de afecciones inflamatorias del intestino, junto a la colitis ulcerativa y la indeterminada, el de Crohn es un padecimiento crónico, autoinmune, que puede afectar todas las capas del intestino, e incluso, sus estructuras contiguas a través de fístulas. Los índices de incidencia en el mundo registran de 3 a 20 enfermos cada 6 mil habitantes. Sin embargo, la proporción que para algunos pudiera representar un episodio lejano es resultado de una tasa de prevalencia “disparada” 25 veces más que la existente hace cuatro décadas. Conocer al “enemigo” De causas aún indeterminadas, los científicos creen que en la enfermedad de Crohn bacterias y virus inofensivos son atacados por el sistema inmunológico. Durante esta aparente defensa, los glóbulos blancos se concentran en el revestimiento intestinal, provocando una inflamación, que a su vez causa lesiones, llagas y úlceras en la mencionada zona. “Esta afección es capaz de dañar cualquier segmento del aparato digestivo. No es hereditaria, pero hay quienes nacen con una predisposición genética que los hacen más propensos a padecerla, sobre todo si tienen antecedentes patológicos en familiares de primer grado”, explicó el doctor Francisco Lorenzo Castillo, especialista de segundo grado en Medicina General Integral y Gastroenterología del Hospital General Provincial Camilo Cienfuegos de Sancti Spíritus. “De tal modo, esa persona crea anticuerpos contra cualquier agente ambiental: componentes de la dieta, estructuras moleculares o parásitos. Es por eso que hablamos de una dolencia autoinmune”. Entre los factores desencadenantes, el también Máster en Medios Diagnósticos, mencionó los malos hábitos higiénicos y dietéticos, así como el tabaquismo, un vicio que contribuye a la aparición del Crohn y complica el estado del paciente. Dolor abdominal, fiebre, pérdida de peso, fatiga, inapetencia, diarrea acuosa, sensación de que necesita defecar, aun con los intestinos limpios, y hemorragia en el recto resultan algunos síntomas que aparecen en los aquejados. Pero este mal conduce también a dificultades extradigestivas. “Los pacientes pueden presentar lesiones en la piel, alteraciones en el hígado, daños renales, oculares, articulares, en los sistemas biliar y excretor; además, en los análisis aparecen los niveles bajos de albúmina, anomalías en las pruebas de la función hepática, así como el conteo de glóbulos blancos alto y la hemoglobina en descenso”, apuntó el especialista. Anemia, falta de nutrientes esenciales (hierro y vitamina B12), obstrucción intestinal, osteoporosis, crecimiento y desarrollo sexual lento en los niños y fístulas en la vejiga devienen otros problemas asociados al agravamiento de la enfermedad. Períodos de bienestar y reagudización de los síntomas caracterizan a este padecimiento que precisa ser contrarrestado a tiempo, pues quienes lo sufren tienen mayores posibilidades de desarrollar el cáncer de colon y de intestino delgado. “Esta es una enfermedad inflamatoria intestinal que provoca complicaciones extradigestivas. Es esencial la prevención”, aseguró el doctor Lorenzo Castillo.
“Ya casi olvidé el sabor del plátano frito, los frijoles, los productos lácteos… si no sigo una dieta estricta me desestabilizo, sufro diarreas, cólicos muy fuertes y me siento débil, como en el aire”, advirtió el paciente de 64 años, Alberto Fariñas Placencia, quien padece la enfermedad de Crohn. Perteneciente al grupo de afecciones inflamatorias del intestino, junto a la colitis ulcerativa y la indeterminada, el de Crohn es un padecimiento crónico, autoinmune, que puede afectar todas las capas del intestino, e incluso, sus estructuras contiguas a través de fístulas. Los índices de incidencia en el mundo registran de 3 a 20 enfermos cada 6 mil habitantes. Sin embargo, la proporción que para algunos pudiera representar un episodio lejano es resultado de una tasa de prevalencia “disparada” 25 veces más que la existente hace cuatro décadas. Conocer al “enemigo” De causas aún indeterminadas, los científicos creen que en la enfermedad de Crohn bacterias y virus inofensivos son atacados por el sistema inmunológico. Durante esta aparente defensa, los glóbulos blancos se concentran en el revestimiento intestinal, provocando una inflamación, que a su vez causa lesiones, llagas y úlceras en la mencionada zona. “Esta afección es capaz de dañar cualquier segmento del aparato digestivo. No es hereditaria, pero hay quienes nacen con una predisposición genética que los hacen más propensos a padecerla, sobre todo si tienen antecedentes patológicos en familiares de primer grado”, explicó el doctor Francisco Lorenzo Castillo, especialista de segundo grado en Medicina General Integral y Gastroenterología del Hospital General Provincial Camilo Cienfuegos de Sancti Spíritus. “De tal modo, esa persona crea anticuerpos contra cualquier agente ambiental: componentes de la dieta, estructuras moleculares o parásitos. Es por eso que hablamos de una dolencia autoinmune”. Entre los factores desencadenantes, el también Máster en Medios Diagnósticos, mencionó los malos hábitos higiénicos y dietéticos, así como el tabaquismo, un vicio que contribuye a la aparición del Crohn y complica el estado del paciente. Dolor abdominal, fiebre, pérdida de peso, fatiga, inapetencia, diarrea acuosa, sensación de que necesita defecar, aun con los intestinos limpios, y hemorragia en el recto resultan algunos síntomas que aparecen en los aquejados. Pero este mal conduce también a dificultades extradigestivas. “Los pacientes pueden presentar lesiones en la piel, alteraciones en el hígado, daños renales, oculares, articulares, en los sistemas biliar y excretor; además, en los análisis aparecen los niveles bajos de albúmina, anomalías en las pruebas de la función hepática, así como el conteo de glóbulos blancos alto y la hemoglobina en descenso”, apuntó el especialista. Anemia, falta de nutrientes esenciales (hierro y vitamina B12), obstrucción intestinal, osteoporosis, crecimiento y desarrollo sexual lento en los niños y fístulas en la vejiga devienen otros problemas asociados al agravamiento de la enfermedad. Períodos de bienestar y reagudización de los síntomas caracterizan a este padecimiento que precisa ser contrarrestado a tiempo, pues quienes lo sufren tienen mayores posibilidades de desarrollar el cáncer de colon y de intestino delgado. “Esta es una enfermedad inflamatoria intestinal que provoca complicaciones extradigestivas. Es esencial la prevención”, aseguró el doctor Lorenzo Castillo.












Los lectores comentan