Una nueva estrategia inmunológica incrementa de forma significativa la supervivencia en adenocarcinoma ductal.
Investigadores del Centro Integral del Cáncer Sidney Kimmel de la Universidad John Hopkins, de Baltimore, acaban de presentar el primer estudio que muestra la efectividad de la inmunoterapia en cáncer de páncreas.
Su directora, Dung T. Le, asegura que se trata de una prometedora vacuna combinada destinada a pacientes con cáncer metastásico de páncreas, una enfermedad de mal pronóstico en la que la mediana de supervivencia de 11 meses se alcanza con tratamiento de primera línea con quimioterapia Folfirinox. Sin embargo, los efectos adversos que conlleva este régimen terapéutico hacen que sólo pacientes muy seleccionados puedan beneficiarse de él.
La investigación, dada a conocer durante el pasado fin de semana en San Francisco, ha sido uno de los temas estrella del Simposio de Cánceres Gastrointestinales de la Asociación Americana de Oncología Médica (ASCO). Esta cita tiene un marcado carácter multidisciplinar que implica a otras sociedades científicas, como el Instituto Americano de Gastroenterología, o las sociedades de radioterapia oncológica y de oncología quirúrgica.
La directora del estudio ha recalcado que las tasas de supervivencia de enfermos de cáncer pancreático avanzado tratados con otros regímenes de quimioterapia son aún menores. «Cuando la enfermedad progresa a pesar de la primera línea de tratamiento, la mediana de supervivencia se queda entre cuatro y seis meses en segunda línea, y sólo entre dos y cuatro meses si el paciente es tratado en tercera línea», puntualiza Dung Le.
Estudio en fase II
El estudio ha evaluado una estrategia inmunológica innovadora que en fase II revela mejores resultados para los pacientes y mayor tolerancia que la quimioterapia en el tratamiento del adenocarcinoma ductal metastásico de páncreas. Se trata de dos vacunas distintas: la GVAX Páncreas -a base de células cancerosas pancreáticas modificadas genéticamente para segregar la proteína GM-CSF que estimula el sistema inmunitario- y la CRS-207, que es una forma de bacteria Listeria monocitogenes, también modificada para adaptarla al uso humano, y estimular la respuesta inmune contra la proteína mesotelina, que tiene alta presencia en las células cancerosas de páncreas.
«La combinación de ambas vacunas pretende estimular la respuesta inmune contra las células tumorales de páncreas, algo que hemos podido comprobar que mejora el sistema inmune innato y lo entrena para reconocer los ataques de los tumores pancreáticos», explica Dung T. Le.
Las grades diferencias en supervivencia se observan en pacientes que recibieron por lo menos dos dosis de GVAX y al menos una de CRS-207, y en los que recibieron dos o más regímenes de tratamiento con anterioridad. La experta ha dicho que para el cáncer avanzado de páncreas se están usando varios fármacos quimioterápicos, pero no hay tratamiento estándar para las terapias de segunda o tercera línea.
En el estudio han participado 90 pacientes con adenocarcinoma ductal de páncreas metastásico, la forma más común de estos cánceres, que se trataron con GVAX seguido de CRS-207 (grupo A) o sólo con GVAX (grupo B). Casi todos ellos habían sido tratados previamente con quimioterapia. La mediana de supervivencia fue significativamente mayor en el grupo de las dos vacunas (6,1 meses versus 3,9 meses). El 24 por ciento de los pacientes en el grupo A seguían vivos después de un año, frente al 12 por ciento de los del B.
Más ensayos clínicos en el horizonte
Los autores del trabajo seguirán investigando las posibilidades de la nueva estrategia inmunológica. De hecho, ya han iniciado otro estudio en fase II en el que se evaluarán tres combinaciones distintas de las dos vacunas. El equipo de Dung T. Le también explorará el uso de GVAX/CRS-207 con fármacos que actúan sobre el sistema inmune, como el anticuerpo monoclonal ipilimumab. Se analizará la utilidad de GVAX/ipilimumab como terapia de mantenimiento en pacientes con enfermedad estable tras la administración de Folfirinox.
Tomado de: Diario Medico.
 Helicobacter enterohepáticos distintos de Helicobacter pylori.
Helicobacter enterohepáticos distintos de Helicobacter pylori. Peroral Endoscopic Myotomy for the Treatment of Achalasia: An Analysis
Peroral Endoscopic Myotomy for the Treatment of Achalasia: An Analysis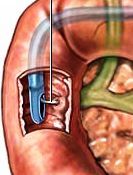
 Necrosectomía pancreática endoscópica.
Necrosectomía pancreática endoscópica.











Los lectores comentan