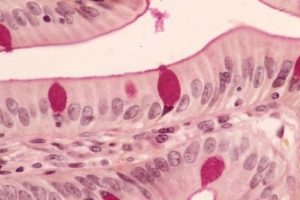
La técnica de Schiff, es una reacción que se usa comúnmente en Histoquímica. Utiliza PAS, ácido peryódico de Schiff, o leucofucsina, un colorante incoloro, pero que se torna rojo estable al contacto con los grupos aldehídos.
La técnica de PAS se utiliza en el laboratorio dentro de los preparados para microscopía óptica, permitiendo la tinción de componentes celulares que contienen hidratos de carbono, por ejemplo algunas membranas celulares, células caliciformes en la mucosa del intestino, fibras reticulares que están rodeados por hidratos de carbono, etc. Entonces en esta técnica, el ácido peryódico oxida a los grupos oxhidrilo (–OH) de dos carbonos cercanos, formando de esta manera grupos aldehídos compuestos por carbono, oxígeno e hidrógeno. Así la leucofucsina puede reaccionar con estos y dejar una tinción rojiza.
Usos
Procedimiento
Partimos de muestras fijadas e incluidas en parafina. Estas muestras se han cortado en secciones de unas 8 µm y adheridas a portaobjetos recubiertos con gelatina.
1.- 2×10 min en xileno para desparafinar
2.- 2×10 min en etanol 100º
3.- 10 min en etanol 96º
4.- 10 min en etanol 80º
5.- 10 min en etanol 50º
6.- 5 min en H2O destilada
7.- Ácido peryódico al 0.5 % durante 5 min
Se oxidan las uniones carbono-carbono de los azúcares para formar grupos aldehídos.
8.- varios lavados en H2O destilada
9.- Reactivo de Schiff durante 30 min en oscuridad (el tiempo depende de la temperatura)
Los grupos aldehídos reaccionan con el reactivo de Schiff (ácido sulfuroso con fucsina) resultando en un color rojo fucsia. Las secciones quedan de un color rosado intenso.
Se puede dar un paso con una solución de metabisulfito potásico (o sódico) durante 2 minutos para eliminar los residuos de reactivo de Schiff de la muestra.
10.- 5 min en agua corriente
11.- Varios lavados en H2O destilada
12.- 5 min en hematoxilina de Mayer
13.- 15 min en agua corriente
14.- 20 s en H2O destilada
15.- 5 min en etanol 80º
16.- 5 min en etanol 96º
17.- 2×10 min en etanol 100º
18.- 2×10 min en xileno
19.- Montado con medio de montaje
Resultados
Glúcidos: rojo intenso a fucsia
Núcleos: azul oscuro (en realidad se tiñe sólo la cromatina)
Consejos
El tiempo en reactivo de Schiff depende de la temperatura. Incluso se puede teñir en microondas durante menos de un minuto.
El reactivo de Schiff puede reutilizarse pero ha de conservarse en nevera y llevarlo a la temperatura deseada antes de su uso.
El reactivo de Schiff debe conservar un color amarillento y hay que descartarlo si se vuelve de color rosado. Si aparece precipitado blanco en el fondo del bote de reactivo se puede disolver de nuevo.
Referencias
Técnicas histológicas del Departamento de Histología del ICBP «Victoria de Girón»
Atlas de Histología Vegetal y Animal. Técnicas histológicas. Protocolos.https://mmegias.webs.uvigo.es/6-tecnicas/protocolos/p-tincion-pas-h.php
Wikipedia: https://es.wikipedia.org/wiki/T%C3%A9cnica_de_Schiff