 La sección «Caso del Mes – noviembre 2023» de la Sociedad Española de Anatomía Patológica presenta el caso de una mujer de 50 años fumadora con antecedente de nefrectomía radical derecha en 2021 por carcinoma renal de células claras. Ampliar…
La sección «Caso del Mes – noviembre 2023» de la Sociedad Española de Anatomía Patológica presenta el caso de una mujer de 50 años fumadora con antecedente de nefrectomía radical derecha en 2021 por carcinoma renal de células claras. Ampliar…
 El schwannoma es un tumor que surge de las células de Schwann de las vainas nerviosas. El objetivo de este artículo es describir las características clínico-patológicas de este caso y compararlo con la literatura revisada sobre el tema. Se presenta el caso de un paciente masculino, de 47 años de edad, en estudio por clínica miccional. Ampliar…
El schwannoma es un tumor que surge de las células de Schwann de las vainas nerviosas. El objetivo de este artículo es describir las características clínico-patológicas de este caso y compararlo con la literatura revisada sobre el tema. Se presenta el caso de un paciente masculino, de 47 años de edad, en estudio por clínica miccional. Ampliar…
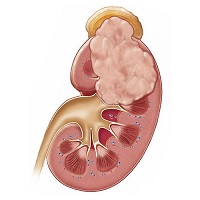 El trasplante renal es la terapia de elección para la mayoría de los pacientes con insuficiencia renal crónica. El tratamiento inmunosupresor muestra asociaciones con enfermedades neoplásicas. El objetivo de este estudio fue caracterizar las enfermedades neoplásicas en los pacientes con trasplante renal funcional. Ampliar…
El trasplante renal es la terapia de elección para la mayoría de los pacientes con insuficiencia renal crónica. El tratamiento inmunosupresor muestra asociaciones con enfermedades neoplásicas. El objetivo de este estudio fue caracterizar las enfermedades neoplásicas en los pacientes con trasplante renal funcional. Ampliar…
Conocer los mecanismos por los que el cáncer renal aparece y se desarrolla puede suponer ir un paso por delante de esta enfermedad, aumentando así las posibilidades de luchar contra ella. Científicos de varios países han estudiado los defectos genéticos presentes en el núcleo de los tumores de riñón y han logrado identificar a los implicados en los primeros estadios del desarrollo del cáncer, lo que podría convertirlos en diana de nuevas terapias.
Desvelan-los-defectos-geneticos-implicados-en-el-inicio-del-cancer-de-rinon_image_380La revista Nature Genetics ( doi:10.1038/ng.2891 ) ha publicado los resultados de un estudio, liderado por la organización Cancer Research UK del Reino Unido y en el que también participan expertos del Instituto de Biomedicina y Biotecnología de Cantabria (IBBTEC), que analiza los defectos genéticos presentes en el núcleo de los tumores de riñón.
Los científicos analizaron el complejo escenario genético presente en los tumores de diez pacientes de cáncer renal y encontraron solo dos defectos genéticos que estaban presentes en todas las muestras obtenidas del mismo tumor. Y, lo que es más importante, eran estos dos defectos los que estaban implicados en el inicio del cáncer.
Más allá de estas mutaciones que componen el tronco del tumor, por sus regiones se extienden, como si fuera un árbol, numerosas ramas. Casi tres cuartos de los defectos encontrados son únicos para cada una de las ramas, una variabilidad enorme que hace muy difícil estudiar la genética de un tumor a partir de una muestra o biopsia única.
Los investigadores creen que este conocimiento puede ser útil para predecir las rutas genéticas de los tumores en progresión
Esto explica por qué los médicos no cuentan con una visión global de la enfermedad en pacientes con este tipo de tumores, y también por qué ciertos tratamientos no son tan efectivos como se espera al atacar solo a una de las ramas, mientras el resto crece y coloniza el espacio liberado.
Frenar la progresión de los tumores
El estudio también ha encontrado similitudes en las rutas evolutivas elegidas por cada una de las ramas, tanto dentro del tumor de cada paciente como entre distintos afectados. Los investigadores creen que este conocimiento puede ser útil para predecir las rutas genéticas de los tumores en progresión, lo que podría servir, a su vez, para diseñar nuevas estrategias terapéuticas que limiten ese crecimiento.
Los científicos aseguran haber alcanzado, con su trabajo, «una visión fascinante de la evolución genética de los tumores», que abre las puertas a importantes avances en el conocimiento y tratamiento del cáncer. «En primer lugar, necesitamos maneras de atacar los defectos que inician el proceso y que se encuentran en el tronco del desarrollo evolutivo. Si además logramos entender las rutas evolutivas que están predeterminadas en el progreso tumoral, podremos mantenernos un paso por delante de la enfermedad».
El equipo que ha participado en el estudio está formado por investigadores del London Research Institute, del Hospital Royal Marsden y del University College London Cancer Institute –los tres británicos-, del MD Anderson Cancer Center de Houston (Estados Unidos) y del IBBTEC, centro mixto del CSIC, la Universidad de Cantabria y Sodercan.
febrero 3/201(SINC)
Marco Gerlinger, Stuart Horswell, James Larkin, Andrew J Rowan, Max P Salm, Ignacio Varela.Genomic architecture and evolution of clear cell renal cell carcinomas defined by multiregion sequencing.Nature Genetics.2 Feb 2014.
En: Noticias ![]()
Investigadores del grupo de Fisiopatología Renal (CIBBIM-Nanomedicine) del Vall d’Hebron Institut de Recerca (VHIR) han confirmado la relación entre una proteína de membrana de células renales, la proteína HAVCR-1/KIM1, y el riesgo de desarrollar cáncer renal, concretamente del tipo célula clara (ccRCC) y papilar. Asimismo, han establecido una asociación los niveles de la proteína con el grado y la malignidad del tumor. Así, la proteína HAVCR-1/KIM1 se confirma como un marcador de gran utilidad para el diagnóstico y pronóstico de tumores de células renales.
Aunque la proteína se detecta en cáncer renal de célula clara (ccRCC) y papilar, este trabajo, publicado en el European Journal of Cancer (doi:10.1016/j.ejca.2012.12.020), ha demostrado que únicamente en los pacientes que desarrollan ccRCC y no otros tipos de tumores, la proteína HAVCR-1/KIM1 se expresa también en la parte normal del riñón, es decir, en la parte donde no hay evidencia de tumor. «Por lo tanto los resultados apuntan a que la expresión anómala de esta proteína en el tejido renal confiere susceptibilidad a desarrollar tumores del tipo ccRCC y también detecta su presencia en etapas iniciales», resume la Dra. Anna Meseguer, responsable del grupo de Fisiopatología Renal (CIBBIM-Nanomedicine) del VHIR y del estudio.
El carcinoma renal (RCC) es el más habitual de los cánceres urológicos, con una mortalidad de 100 000 casos/año en todo el mundo. Representa el 3% de todos los nuevos casos de cáncer y su incidencia ha ido en aumento durante las últimas 3 décadas. Existen varios tipos de cáncer renal, pero el más frecuente, con diferencia, es el llamado «de células claras» (ccRCC), que representa el 75-80% de todos los tumores renales, y que es, a la vez, uno de los más agresivos. «Uno de los problemas principales de este tipo de cáncer es que no presenta signos, síntomas o anomalías bioquímicas que permitan su detección precoz. En algunos casos se detecta de forma incidental, entonces la enfermedad suele estar ya muy avanzada, con pocas posibilidades de curación y por consiguiente su mortalidad es muy elevada (95%). Hasta el momento, no existe ningún modo de detectarlo precozmente de manera específica», señala el Dr. Enric Trilla, médico adjunto del Servicio de Urología del Hospital Universitari Vall d’Hebron.
Cribado del cáncer renal
El estudio se ha llevado a cabo analizando muestras de pacientes de una media de edad de 64 años, con diferentes subtipos de tumores de células renales y en varios grados de desarrollo. Los investigadores del VHIR, en colaboración con el Servicio de Urología del Hospital Universitari Vall d’Hebron, han descubierto que la proteína HAVCR-1/KIM1, ya conocida como marcador de daño renal, está sobreexpresada en tumores renales del tipo ccRCC y papilar, pero que sólo se encuentra expresada de forma anómala en muestras de túbulos proximales no tumorales de pacientes que presentaban tumores de células claras (ccRCC).
La proteína, detectada en la orina, puede ser un buen marcador de recaída en pacientes a quienes ya se les ha extirpado el tumor renal. «Por otra parte, el cribado poblacional de este marcador en orina podría ser, una vez contrastado con otros marcadores conocidos de daño renal inespecífico (urea/creatinina, NGAL, etc.), un buen indicador para detectar la población con riesgo de desarrollar un carcinoma del tipo ccRCC, ya que es en estos pacientes donde se expresa esta proteína de forma anormal», explica la Dra. Meseguer. Y añade: «Analizando todos estos datos podemos afirmar que HAVCR-1/KIM1 permite diferenciar el ccRCC del resto de tumores, por lo cual esta proteína tiene un gran valor terapéutico de cara a desarrollar sistemas de diagnóstico precoz».
Tras descartar otros posibles motivos de aumento de esta proteína, los investigadores creyeron que esta aparición inesperada debía de estar relacionada con el riesgo de desarrollar tumores del tipo ccRCC, y sugirieron que anomalías en la expresión de HAVCR-1/KIM1 confieren susceptibilidad a la enfermedad. «A nivel genético, las secuencias que codifican la proteína KIM1 se encuentran en la región 5q, frecuentemente amplificada en tumores del tipo ccRCC», indica la Dra. Meseguer, «lo cual nos confirma más aún nuestras hipótesis de trabajo y también podría abrir una vía para determinar el pronóstico de ccRCC a nivel genético».
Grado y la malignidad de los tumores
El exceso de esta proteína se puede detectar, tanto por su actividad inmunológica en los tejidos como por su presencia en la orina. «Lo que hemos visto es que los pacientes que pierden más activamente la parte extracelular de la proteína en la orina padecen tumores más agresivos que los que la conservan en la membrana. Los niveles de HAVCR-1/KIM1 en la orina están relacionados con la cantidad de proteína producida por el tumor y, al mismo tiempo, con la capacidad de cada individuo para «cortar» la parte extracelular de la proteína. Por lo tanto, la presencia de la proteína en la orina y sus niveles permiten determinar la presencia de un tumor de ccRCC y a la vez su agresividad», concreta la Dra. Meseguer.
Según concluye esta especialista, «tenemos el convencimiento de que nos hallamos ante el primer y único marcador precoz de cáncer renal. Parece factible y fácil detectar HAVCR-1/KIM1 en orina en estadios muy iniciales del desarrollo de tumores renales de células claras. Esto lo convierte en un excelente biomarcador para llevar a cabo un diagnóstico específico y precoz de los tumores de células renales y podría cambiar el escenario actual de este tumor de tan mal pronóstico».
marzo 12/2013 (JANO)
Thaïs Cuadros, Enric Trilla, Maria Rosa Vilà, Inés de Torres, Jordi Vilardell, Nabil Ben Messaoud.Hepatitis A virus cellular receptor 1/kidney injury molecule-1 is a susceptibility gene for clear cell renal cell carcinoma and hepatitis A virus cellular receptor/kidney injury molecule-1 ectodomain shedding a predictive biomarker of tumour progression.European Journal of Cancer (2013)
En: Diagnóstico, Noticias ![]()
El tratamiento del carcinoma renal, basado en la terapia antiangiogénica, podría mejorar con la obtención de nuevos biomarcadores.
El Instituto de Oncología Valle de Hebrón (VHIO) y el Hospital Universitario Valle de Hebrón, ambos en Barcelona, han organizado una reunión científica sobre carcinoma de células renales, que ha contado con la participación de expertos procedentes del Centro Oncológico Taussig de Cleveland (Estados Unidos) y del Instituto de Investigación Biomédica de Bellvitge (Idibell), de Barcelona.
El objetivo de la reunión era proporcionar una actualización de los últimos avances en cáncer renal y ofrecer la posibilidad de debatir y compartir opiniones. Como ha recordado Brian Rini, profesor asociado de Medicina de la Universidad de Cleveland, la terapia antiangiogénica es la más relevante en cáncer renal. «En Estados Unidos se administran fármacos como sunitinib en primera línea al menos en el 60 % de los pacientes, con otras opciones en segunda línea y nuevos agentes recientemente aprobados. En la actualidad, optamos por una secuencia de monoterapias, aunque debe mejorarse, porque no sabemos qué fármaco es mejor para un paciente determinado con respecto a otro. Pero pensamos que sunitinib es la mejor opción y, cuando fracasa el tratamiento, optamos por otro y por el seguimiento», ha enumerado.
En su opinión, para mejorar la situación actual es preciso impulsar la investigación en nuevos biomarcadores predictivos validados, pero, «desgraciadamente, no los tenemos todavía, aunque hay algún indicio». Entre los trabajos en este campo ha citado el de Jesús García-Donas, que fue publicado por The Lancet Oncology el pasado mes de octubre, en el que se describía cómo determinados polimorfismos de un solo nucleótido (SNP) se correlacionaban con respuesta a fármaco o toxicidad.
«Hemos trabajado mucho en hipertensión inducida a la célula por cambios de presión pero, de nuevo, tampoco puede usarse en la práctica clínica para seleccionar a los pacientes. Como he indicado, tenemos algunas pistas, pero creo que pasarán muchos años antes de que dispongamos de una herramienta similar a la mutación EGFR en cáncer de pulmón, de manera que, si el paciente la tiene, se le administra un fármaco determinado y, si no, le administro otro; eso es lo que necesitamos», ha asegurado.
Diversidad en respuesta
Su investigación se centra en nuevos fármacos y en estos nuevos marcadores con modelos animales de resistencia, que intentan responder a por qué los pacientes reaccionan a uno u otro tratamiento, o se vuelven resistentes a él y qué hacer a continuación. También trabaja en nuevas pautas de administración intermitente, tratando de reducir los efectos secundarios manteniendo la efectividad.
El carcinoma renal es una enfermedad tanto de diagnóstico como de manejo complejo. Como ha indicado Rini, responsable de la Unidad de Tumores Sólidos del Centro Oncológico Taussig de Cleveland, «la mayoría de los pacientes no tienen síntomas y al someterse a una tomografía computarizada por otro motivo se descubre que tienen una anomalía en el riñón o en otra región».
En cuanto al manejo, ha indicado que la incorporación de nuevos fármacos está haciéndolo cada vez más complejo: «Cuando comencé a trabajar en este campo sólo disponíamos de interferón e interleucina y era sencillo; ahora tenemos ocho tratamientos aprobados por la Aagencia -estadounidense- de Alimentos y Fármacos ( FDA), con diferentes mecanismos y efectos secundarios; ahora es más difícil».
EN COLABORACIÓN
Brian Rini, de la Universidad de Cleveland, ha alabado el esfuerzo colaborativo y la necesidad de impulsar jornadas como la celebrada en el Hospital Valle de Hebrón, «porque no hay un centro en el mundo que pueda hacerlo todo. Nosotros tenemos experiencia desde el punto de vista clínico y de laboratorio en determinadas áreas, mientras que en otros centros son fuertes en otros aspectos. Esto nos permite multiplicar nuestros esfuerzos y abrir nuestras mentes para trabajar mejor: tales colaboraciones internacionales son extremadamente útiles».
Julio 29/2012 (Diario Médico)
Garcia-Donas, Jesus Esteban, Emilio Leandro-García, Luis Javier Castellano, Daniel E. del Alba, Aranzazu González Climent, Miguel Angel Arranz, et. al. Single nucleotide polymorphism associations with response and toxic effects in patients with advanced renal-cell carcinoma treated with first-line sunitinib: a multicentre, observational, prospective study. The Lancet Oncology, 12 (12), p.1143-1150, nov 2011.
En: Noticias ![]()
 Los carcinomas de células renales constituyen el 90 % de todas las neoplasias malignas renales. Los pacientes con este diagnóstico presentan dolor en flancos, hematuria y masa abdominal palpable. Sin embargo, la mayoría de los diagnósticos se dan por hallazgos incidentales de imagenología.
Los carcinomas de células renales constituyen el 90 % de todas las neoplasias malignas renales. Los pacientes con este diagnóstico presentan dolor en flancos, hematuria y masa abdominal palpable. Sin embargo, la mayoría de los diagnósticos se dan por hallazgos incidentales de imagenología. 











